Les protéines sont le principal matériau de construction des organismes. Différentes protéines ont des fonctions différentes. Si nous considérons le corps comme un bâtiment, nous pouvons accepter la plupart des matériaux et des composants de la construction, tels que le fer, la brique, le ciment, les fenêtres et les ascenseurs, comme des protéines dans l’organisme.
Les protéines sont principalement composées de carbone (C), d’hydrogène (H), d’oxygène (O), d’azote (N) et de soufre (S). Cependant, le phosphore (P), le fer (Fe), le cuivre (Cu) et le zinc (Zn) peuvent également être trouvés dans la structure des protéines.
Les éléments constitutifs des protéines sont les acides aminés. Bien qu’il existe des protéines composées uniquement d’acides aminés, certaines protéines contiennent différentes molécules telles que les glucides et les graisses.
Acides aminés
Bien que près de 200 acides aminés soient détectés dans la nature, généralement, 20 de ces acides aminés se retrouvent dans la structure des protéines.
Les acides aminés sont des molécules constituées de chaînes carbonées qui contiennent au moins un groupe carboxyle (-COOH) et au moins un groupe amino (-NH2) dans leur structure (la proline a un groupe imino (-NH)). Le nombre de carbones dans la chaîne varie généralement entre 2 et 11, selon le type d’acide aminé.
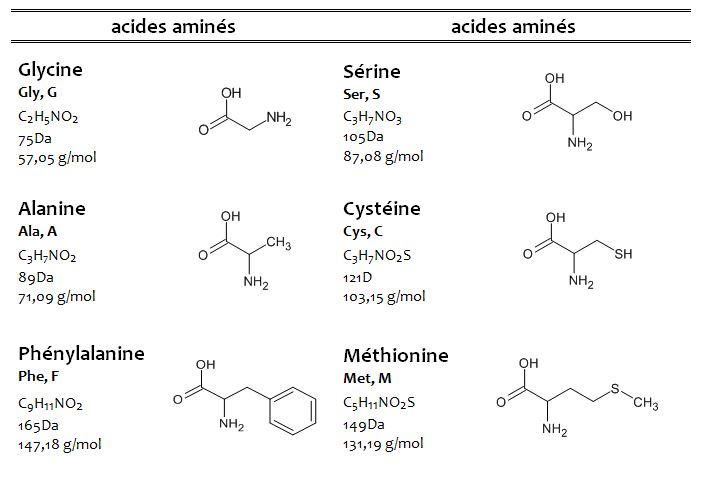
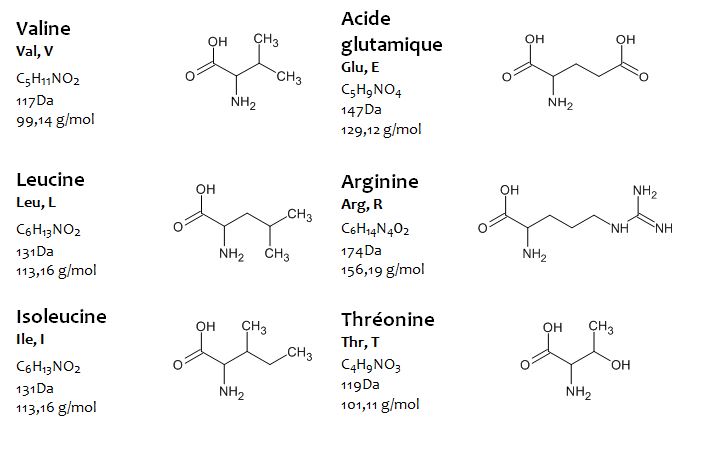

La glycine, l’acide aminé le plus simple, est constituée d’un groupe carboxyle et d’un groupe amino liés à 1 atome de carbone et contient deux atomes de carbone.
Une liaison peptidique est formée entre le groupe carboxyle d’un acide aminé et le groupe amino de l’autre acide aminé. Ainsi, la structure formée par la combinaison de deux acides aminés est appelée dipeptide et le réseau formé par la connexion de trois acides aminés avec une liaison peptidique est appelé tripeptide.
Les protéines sont des peptides généralement constitués de 100 acides aminés ou plus. Cependant, certains d’entre eux contiennent moins de 100 acides aminés.
Le nombre d’acides aminés, la longueur de la chaîne et l’ordre contenus dans une protéine sont codés dans l’ADN de l’organisme, produisant cette protéine. C’est pourquoi les protéines sont uniques pour chaque organisme vivant.
Structure des protéines
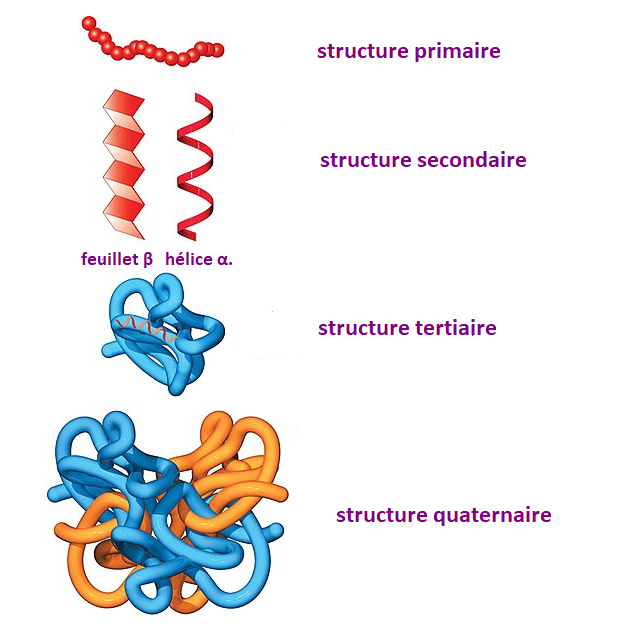
La structure dans laquelle les acides aminés se combinent pour former une chaîne est la “structure primaire” des protéines. Cependant, cette structure ne reste pas en chaîne droite. Les acides aminés de la chaîne interagissent les uns avec les autres et à la suite de cette interaction, des plis se produisent dans la chaîne.
À la suite de l’interaction, des liaisons hydrogène se forment généralement entre les atomes d’oxygène et d’azote. Généralement, un repliement a lieu dans 4 acides aminés. En conséquence, la protéine acquiert une structure en hélice; cette structure de protéines est appelée “structure secondaire.” La myosine, la kératine et l’épiderme sont des protéines possédant des structures secondaires.
Les liaisons hydrogène qui assurent la formation de la structure secondaire sont des liaisons faibles, mais la construction d’un trop grand nombre de liaisons hydrogène dans le réseau rend la structure secondaire stable.
Cependant, si deux acides aminés soufrés coïncident dans les plis de la chaîne, une liaison disulfure (S-S) s’établit également entre ces deux acides aminés. La liaison disulfure dans la structure secondaire rend la structure beaucoup plus solide. En général, les protéines présentent des structures secondaires de deux manières différentes: feuillet β et hélice α.
La structure secondaire formée prend une structure plus complexe en montrant des liaisons hydrogène, des liaisons disulfure, des liaisons de van der Waals et des interactions hydrophobes. Cette structure de protéines est appelée “structure tertiaire.” Les protéines globulaires présentent généralement une structure tertiaire.
La “structure quaternaire” émerge lorsque plus d’une chaîne polypeptidique se réunit avec ces interactions, L’hémoglobine est une protéine à structure quaternaire.
Chaque protéine a des poids moléculaires différents en fonction du nombre d’acides aminés. L’insuline pèse 6 000 Da tandis que l’uréase pèse 480 000 Da.
Classification des protéines
Les protéines peuvent être classées selon différents paramètres. Ces classifications sont les suivantes;
I) Selon la configuration
II) Selon la composition chimique
III) Selon la fonction
I) Selon la configuration
1. Fibreux; sont des protéines en forme de bâtonnets insolubles dans l’eau. Le collagène, la kératine, l’élastine et la tropomyosine peuvent être cités comme exemples.
2. Globulaire; sont des protéines rondes solubles dans l’eau. L’albumine sérique, l’hémoglobine, les enzymes, les anticorps et les hormones peuvent être cités comme exemples.
II) Selon la composition chimique
1. Simplicité; sont des protéines qui ne libèrent que des acides aminés et leurs dérivés lorsqu’elles sont hydrolysées. Des exemples sont les albumines, les globulines, les glutélines, les prolamines, les protamines, les histones, le collagène, la kératine, la fibrine, la myosine, l’élastine et l’épiderme.
2. Conjuguées; sont des protéines qui libèrent des substances autres que les acides aminés et leurs dérivés lorsqu’elles subissent une hydrolyse. Des exemples comprennent les phosphoprotéines, les lipoprotéines, les glycoprotéines, les nucléoprotéines, les chromoprotéines et les métalloprotéines.
III) Selon la fonction
1. Enzymes; comme l’amylase et la lactase.
2. Structurelles; such as glycoproteins and lipoproteins.
3. Contractiles; la myosine, l’actine et la tubuline peuvent être citées comme exemples.
4. Hormones; comme l’insuline et les hormones de croissance.
5. Transporteurs; tels que l’hémoglobine, la transferrine et l’albumine sérique.
6. Stockages; comme la Hardeine et la gliadine.
7. Défenses; comme les anticorps et les immunoglobulines.
8. Toxiques; comme le venin de serpent et la ricine.
Cet article peut également vous intéresser; Protéines; Fonctions dans l’organisme, qualité des protéines et besoins quotidiens en protéines
Be First to Comment